

來源:生物世界 2023-01-11 10:20
去年,FDA批準了世界首個靶向Aβ的藥物——aducanumab,但實際療效缺乏證據,而且售價高昂(5.6萬美元/年),以至于醫生并不愿意給阿爾茨海默病患者開這種藥物。
FDA批準了一款阿爾茨海默病新藥——lecanemab,旨在減緩輕度和早期阿爾茨海默病患者的認知能力下降,費用為每年26500美元,這一價格遠低于FDA批準的上一款阿爾茨海默病藥物aducanumab的每年5.6萬美元的價格。

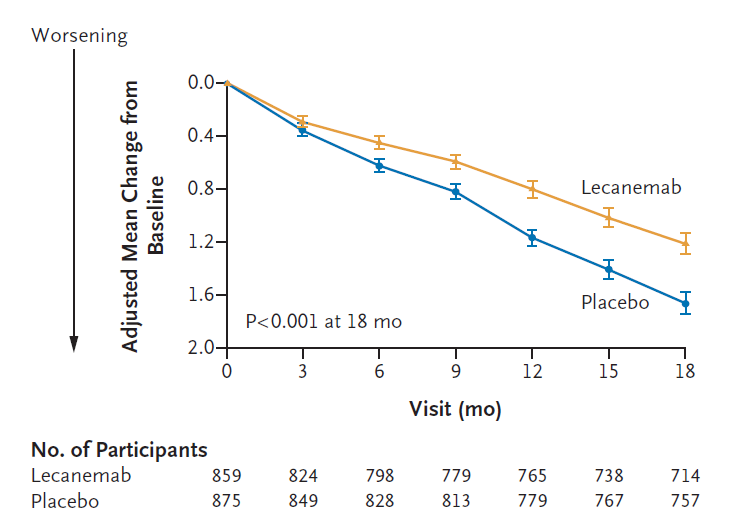
lecanemab同樣由衛材(Eisai)和渤健(Biogen)合作開發,該藥物的獲批上市,基于2022年11月29日發表于《新英格蘭醫學雜志》(NEJM)的三期臨床試驗結果,這項針對近1800名早期阿爾茨海默病患者的臨床試驗結果顯示,該藥物能使阿爾茨海默病患者的認知能力下降速度減慢27%。
但臨床試驗結果中的不良反應引發爭議,接受改藥物治療17.3%的患者出現了腦出血(安慰劑對照組為9%),12.6%的患者出現了腦腫脹(安慰劑對照組為1.7%)。但FDA還是批準了該藥物上市。
2021年6月7日,FDA宣布加速審批衛材(Eisai)和渤健(Biogen)合作開發的單抗藥物aducanumab(商品名Aduhelm)上市,用于治療阿爾茨海默病源性輕度認知障礙(MCI)及輕度阿爾茨海默病。這是自2003年以來,FDA批準的首個阿爾茨海默癥治療新藥,也是首個能阻止疾病進展的藥物。
aducanumab
aducanumab獲得FDA批準后,立即引發了巨大爭議,臨床試驗顯示,這款單抗藥物能夠清除大腦中的β-淀粉樣蛋白(Aβ),但沒有足夠證據表明其能夠減緩或阻止阿爾茨海默病的疾病進展。此外,該藥物還存在副作用風險,在10mg/kg劑量組的1029名患者中,425名患者(41.3%)經歷了 淀粉樣蛋白相關成像異常(ARIA)問題,362名患者(35.2%)出現ARIA腦水腫,其中94人出現了相關癥狀,例如頭痛、意識模糊、頭暈和惡心。197名患者(19.1%)出現了ARIA微出血,151名患者(14.7%)出現了ARIA表層鐵沉積。在這些出現副作用的患者中,有14人情況嚴重。
2022年11月29日,衛材(Eisai)和渤健(Biogen)開發的另一款阿爾茨海默病藥物lecanemab的3期臨床試驗結果在《新英格蘭醫學雜志》(NEJM)發表,這項針對近1800名早期阿爾茨海默病患者的臨床試驗結果顯示,這款阿爾茨海默病新藥能夠適度減緩阿爾茨海默病的惡化。
與aducanumab不同的是,lecanemab是一種人源化IgG1單克隆抗體,其通過與β-淀粉樣蛋白(Aβ)結合而發揮作用,前者則是Aβ單克隆抗體。

這些早期阿爾茨海默病患者在18個月時間里每兩周接受靜脈注射lecanemab或安慰劑,研究人員用18分制來測量他們的認知能力。結果顯示,lecanemab將患者病情惡化的時間推遲了大約5個月。此外,在研究期間,接受lecanemab的患者進展到疾病下一階段的可能性要低31%。但對于這些變化會給患者和家屬帶來多大的影響,醫生們意見不一。
但梅奧醫學中心的阿爾茨海默病專家Ron Petersen博士認為,該藥物的效果不大,但它在臨床上是有意義的。因為即使只是延緩了幾個月的疾病進展,也可以給阿爾茨海默病患者多一點時間,讓他們能夠獨立生活/工作更久。
阿爾茨海默病協會首席科學家Maria Carrillo表示,這項臨床試驗很重要,因為它表明通過藥物靶向淀粉樣蛋白可以延緩阿爾茨海默病發展,我們都知道這不是治愈阿爾茨海默病的方法,我們都在試圖真正理解它對減緩阿爾茨海默癥意味著什么。
Maria Carrillo還表示,在阿爾茨海默病早期延遲認知能力的下降有重要意義,能夠讓患者有更多時間與所愛的人在一起,能夠更多地享受家庭生活,旅游、度假,以及完成遺愿清單。
靶向Aβ的藥物可能會導致包括腦腫脹和腦出血在內的副作用,lecanemab也不例外,大約13%的受者出現了一種類型的腫脹。但衛材公司表示,大多數患者癥狀輕微或無癥狀。
此外,據公開報告,lecanemab在臨床試驗中有兩人死亡,這引發了人們對該藥物的耐受性和安全性的擔憂。衛材公司表示,這兩人因其他健康問題而服用血液稀釋藥物而死亡,因此這些死亡不能歸因于阿爾茨海默病藥物。
全世界有數以千萬計的阿爾茨海默病患者,但僅有寥寥幾種治療方法或藥物,而且都最多只能暫時緩解癥狀。實際上,科學家目前還不清楚阿爾茨海默病究竟是如何形成的,一些理論認為β-淀粉樣蛋白(Aβ)的堆積在阿爾茨海默病發病其中起著關鍵作用,但靶向Aβ的藥物卻鮮有成功。
去年,FDA批準了世界首個靶向Aβ的藥物——aducanumab,但實際療效缺乏證據,而且售價高昂(5.6萬美元/年),以至于醫生并不愿意給阿爾茨海默病患者開這種藥物。