

炎癥是機體應對外來病原微生物和自身損傷的一種正常生理反應,炎癥處于先天免疫和獲得性免疫之間,能夠幫助機體進一步清除病原微生物,并刺激獲得性免疫的啟動。炎癥應答過程起始于細胞的模式識別受體PRRs識別外來病原微生物模式分子PAMP和自身損傷模式分子DAMP,然后通過啟動一系列的信號傳導和聯級反應,激活相關的轉錄因子,最后調控大量的基因表達,從而引發炎癥。在這里,我們就為大家盤點一下在炎癥應答過程中,最重要的三個轉錄因子:NF-κB,IRFs,STATs。
1、NF-κB
NF-κB是一個高度保守的多功能轉錄因子家族,包含五個成員,分別為p65(RelA)、RelB、c-Rel、NF-κB1和NF-κB2,它們會組成不同的同源或異源二聚體而發揮基因轉錄調節作用,進而調節許多重要的細胞行為,特別是炎癥反應[1]。與其他家族成員不同的是,NF-κB1和NF-κB2被合成為前體(p105和p100),并分別可以被加工成p50和p52[2]。
在大多數靜止細胞中,這些二聚體的轉錄調節活性受到NF-κB抑制分子(IκB)的限制,或在加工為成熟形式前受其自身內部抑制基序的限制(比如p105或p100)。當細胞受到各種刺激,含有IKKα、IKKβ和IKKγ(NF-κB必需調節物,也稱為NEMO)的IκB激酶復合物可以被多種上游信號通路(包括多種PRR下游通路、TNF信號通路等)激活,并介導IκB的磷酸化和蛋白酶體降解。然后NF-κB同源或異源二聚體可以轉移到細胞核并激活靶基因轉錄[2]。NF-κB激活的另一種途徑,也被稱為替代途徑,在包括BAFFR、CD40、RANK或LTβR的下游存在時,導致NF-κB誘導激酶(NIK)活化并激活IKKα[3]。IKKα能磷酸化p100并導致p100的多泛素化及其隨后經蛋白酶體被加工為p52。然后,p52-RelB二聚體可以激活靶基因的轉錄。除了上述兩種激活途徑,NF-κB還可以在特定情況下被其他信號通路或激酶激活,稱為非典型激活途徑 [4]。
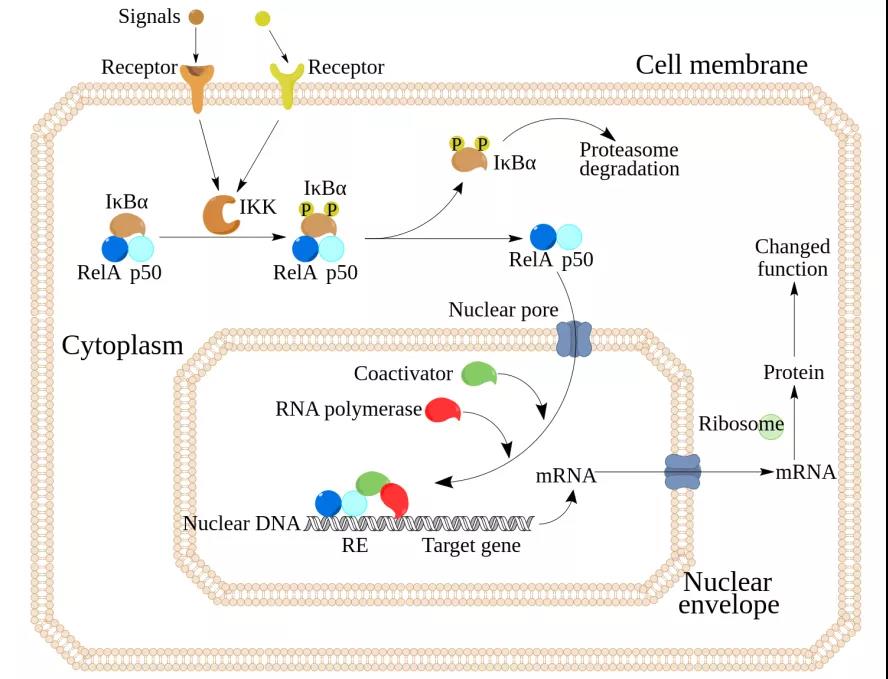
圖1:細胞內NF-κB的信號傳導通路
NF-κB轉錄調控系統的復雜性也體現在如下幾個方面:1)不同的NF-κB二聚體對DNA結合序列的變化有不同的偏好。因此,不同的靶基因由不同的NF-κB二聚體被不同程度上激活[5]; 2)NF-κB家族成員和調節因子還含有磷酸化和其他翻譯后修飾的位點,這些位點對NF-κB的調節和與其他信號通路的串話很重要[4,6];3)在不同的細胞環境下,NF-κB信號通路與其他信號通路之間或NF-κB與其他轉錄因子之間的串話,增加了NF-κB調控和功能的復雜性 [2, 7-13]。
激活的NF-κB會誘導產生大量的促炎細胞因子而誘導炎癥的發生。這些細胞因子分兩類,一類是促進先天免疫免疫的細胞因子,如Ⅰ型干擾素(IFNβ),IL-12和巨噬細胞趨化因子等;另一類是促進獲得性免疫的細胞因子,如IL-1,IL-2,IL-6,IL-8,IL-12,IL-18和Ⅱ型干擾素(IFNγ)等。
2、IRFs
IRFs中文全稱是干擾素調節因子,有9個成員,分別是IRF1-9。IRFs最初被鑒定到的功能是能夠激活Ⅰ型干擾素基因表達,其中IRF1、IRF3、IRF5、IRF7和IRF9都具有這一功能 [14],且IRF3和IRF7的作用最為明顯。Ⅰ型干擾素具有強大的抗病毒功能,能通過激活JAK-STATs通路而誘導表達大量的抗病毒相關蛋白,從而抑制病毒在體內的復制。在機體受到了病毒等病原微生物感染時,PRRs所介導的信號通路除了能夠激活NF-κB之外,還能磷酸化并激活IRF3、IRF5和IRF7,從而使他們進核誘導Ⅰ型干擾素以及其它促炎細胞因子的表達。
除了在已經分化的免疫細胞中發揮功能外,一些IRFs(IRF1、IRF2、IRF4和IRF8)還在未分化的免疫細胞中具有關鍵作用,如DC細胞、NK細胞、髓性細胞、B細胞和T細胞。這些IRFs在激活后,能促進相關的免疫細胞成熟和分化,從而激活獲得性免疫反應 [15]。
與其它IRFs不同,IRF9最主要的功能是和磷酸化的STAT1和STAT2形成蛋白復合物ISGF3,參與JAK-STATs通路,參與Ⅰ型干擾素信號傳導 [16]。
IRFs的功能
| IRFs | 功能 |
|---|---|
| IRF3,IRF5,IRF7 | 誘導產生Ⅰ型干擾素和趨化因子 |
| IRF1,IRF2,IRF4,IRF8 | 參與免疫細胞的分化和發育 |
| IRF9 | 與STAT1和STAT2形成ISGF3蛋白復合體,促進Ⅰ型IFN誘導基因的表達 |
3、STATs
STATs中文名全稱是信號傳導及轉錄激活蛋白,由7個成員組成,分別是STAT1-4,STAT5a和STATs5b和STAT 6,這些成員都主要在細胞因子的應答過程中扮演關鍵角色。當細胞因子與其對應的膜受體結合后,會引起與這些受體相連的JAKs(janus kinase)磷酸化。JAKs的磷酸化又會引起STATs的磷酸化和二聚化,即STATs的活化。STATs活化后會暴露出核定位信號,從而進核并參與基因表達調控[17]。
不同的細胞因子激活不同的STATs蛋白入核,并發揮其特異的功能。Ⅰ型(如IFNα和IFNβ)和Ⅲ型干擾素(如IFN-λ)能激活STAT1和STAT2,激活后的STAT1、STAT2與IRF9組成蛋白復合物ISGF3,ISGF3蛋白復合物結合在含有ISRE元件(interferon-stimulated response element)的啟動子上,并激活相關基因表達。ISRE是干擾素刺激基因ISGs(interferon-stimulated genes)的標志,ISGs主要包括一些能夠抑制病毒復制的酶類。另外,Ⅱ型干擾素(IFN-γ)主要激活STAT1,激活后的STAT1形成二聚體,激活含有GAS(gamma interferon-activated sequence)元件的基因表達。Ⅱ型干擾素的抗病毒作用較弱,但是具有較強的免疫調節功能,能夠刺激免疫細胞的成熟和分化,從而激活獲得性免疫反應[18]。

圖2:IRFs和STATs在細胞應對病毒感染時的信號通路
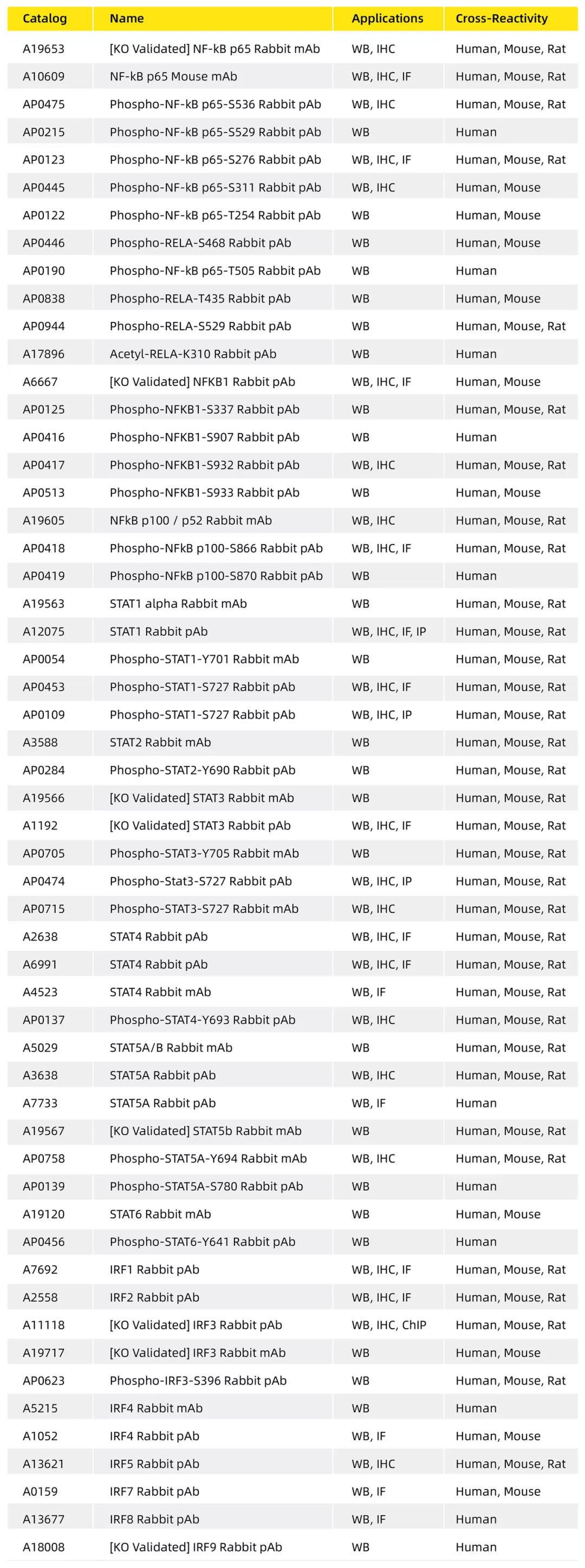
ABclonal 炎癥應答相關轉錄因子抗體產品
炎癥相關轉錄因子的活化往往涉及到轉錄因子蛋白積累量、磷酸化狀態、細胞定位以及蛋白互作等的改變,ABclonal提供了完整的炎癥相關轉錄因子抗體產品,供客戶進行相關研究。
>>>> 參考文獻
1.Oeckinghaus, A., & Ghosh, S. (2009). The NF-?B Family of Transcription Factors and Its Regulation. Cold Spring Harb Perspect Biol, 1(4), a000034-a000034.
2.Hoesel, B., & Schmid, J. A. (2013). Hoesel B, Schmid JA.The complexity of NF-??B signaling in inflammation and cancer. Mol Cancer 12:86. Mol Cancer, 12(1), 86.
3.Sun, S.-C. (2017). The non-canonical NF-κB pathway in immunity and inflammation. Nature Reviews Immunology, 17(9), 545-558.
4.Christian, F., Smith, E. L., & Carmody, R. J. (2016). The Regulation of NF-kappaB Subunits by Phosphorylation. Cells, 5(1). doi:10.3390/cells5010012
5.Mulero, M. C., Wang, V. Y., Huxford, T., & Ghosh, G. (2019). Genome reading by the NF-κB transcription factors. Nucleic Acids Res, 47(19), 9967-9989. doi:10.1093/nar/gkz739
6.Huang, B., Yang, X. D., Lamb, A., & Chen, L. F. (2010). Posttranslational modifications of NF-kappaB: another layer of regulation for NF-kappaB signaling pathway. Cellular Signalling, 22(9), 1282-1290.
7.Oeckinghaus, A., Hayden, M. S., & Ghosh, S. (2011). Crosstalk in NF-κB signaling pathways. Nature Immunology, 12(8), 695-708.
8.Grivennikov, S. I., & Karin, M. (2010). Dangerous liaisons: STAT3 and NF-κB collaboration and crosstalk in cancer. Cytokine & Growth Factor Reviews, 21(1), 0-19.
9.Huang, W. C., Ju, T. K., Hung, M. C., & Chen, C. C. (2007). Phosphorylation of CBP by IKKalpha promotes cell growth by switching the binding preference of CBP from p53 to NF-kappaB. Mol Cell, 26(1), 75-87.
10.Hou, Y., Liang, H., Rao, E., Zheng, W., Huang, X., Deng, L., Fu, Y. X. (2018). Non-canonical NF-kappaB Antagonizes STING Sensor-Mediated DNA Sensing in Radiotherapy. Immunity, 49(3), 490-503 e494. doi:10.1016/j.immuni.2018.07.008
11.NF-κB and HIF crosstalk in immune responses. (2016). Febs Journal, 283(3), 413-424.
12.Morgan, M. J., & Liu, Z.-g. (2010). Crosstalk of reactive oxygen species and NF-κB signaling. Cell Research, 21(1), 103-115. doi:10.1038/cr.2010.178
13.Gupta, S. C., Awasthee, N., Rai, V., Chava, S., & Challagundla, K. B. (2019). Long non-coding RNAs and nuclear factor-B crosstalk in cancer and other human diseases. Biochimica Et Biophysica Acta Reviews on Cancer, 1873(1), 188316.
14.Miyamoto M, Fujita T, Kimura Y, Maruyama M, Harada H, Sudo Y,et al. Regulated expression of a gene encoding a nuclear factor, IRF-1,that specifically binds to IFN-beta gene regulatory elements. Cell (1988)54:903–13.
15.Tamura T, Yanai H, Savitsky D, Taniguchi T. The IRF family transcriptionfactors in immunity and oncogenesis. Ann Rev Immunol. (2008) 26:535–84.doi: 10.1146/annurev.immunol.26.021607.090400
16.Rengachari S, Groiss S, Devos JM, Caron E, Grandvaux N, Panne D. Structural basis of STAT2 recognition by IRF9 reveals molecular insights into ISGF3 function. Proc Nat Acad Sci USA. (2018) 115:E601–9.doi: 10.1073/pnas.1718426115
17.Levy DE, Darnell JEJ. Stats: transcriptional control and biological impact. Nat Rev Mol Cell Biol. (2002) 3:651–2. doi: 10.1038/nrm909
18.Stark GR, Darnell JE. The JAK-STAT pathway at twenty. Immunity (2012)36:503–14. doi: 10.1016/j.immuni.2012.03.013